Fitaza w żywieniu drobiu - część II


W komórkach roślinnych fityniany występują głównie w formie fityny – soli potasowych i magnezowych, rzadziej wapniowych. Ich rozmieszczenie w ziarniakach i nasionach różni się pomiędzy roślinami. W przypadku roślin jednoliściennych (pszenica, jęczmień, ryż) fityniany zlokalizowane są głównie w warstwie aleuronowej, z kolei w kukurydzy ponad 80% występuje w bielmie. Natomiast w nasionach roślin strączkowych fityniany akumulują się w liścieniu, a wewnątrz nasion soi są rozmieszczone równomiernie. Różnice pomiędzy roślinami występują także w samej zawartości kwasu fitynowego, która w zbożach waha się od 0,5 do 2,0%.
Kwas fitynowy (InsP6) strukturalnie składa się z w pełni ufosforylowanego pierścienia mio-inozytolu. Cząsteczka kwasu fitynowego zawiera 12 miejsc wiązania jonów, po dwa dla każdej grupy fosforanowej. Ze względu na mnogość reaktywnych miejsc (12), fityniany mogą wiązać kationy (dwu lub trójwartościowe) nie tylko w obrębie pojedynczej grupy fosforanowej, ale także pomiędzy różnymi grupami fosforanowymi tej samej lub różnych cząsteczek fitynianów. Z cynkiem tworzą najbardziej stabilne sole, następnie kolejno z miedzią, niklem, kobaltem, manganem, wapniem i żelazem. Stabilność i rozpuszczalność mineralnych kompleksów zależy od rodzaju kationu, pH roztworu, stosunku molowego fitynianu i kationu, oraz obecności innych związków w roztworze. Większość kompleksów charakteryzuje się wyższą rozpuszczalnością przy niskiej wartości pH. Jednakże, pomimo iż wapń wykazuje słabe powinowactwo do fityninów, ze względu na jego wysoką koncentrację w diecie, ma największy wpływ na tworzenie nierozpuszczalnych kompleksów z kwasem fitynowym spośród pozostałych składników mineralnych, i tym samym ma największy wpływ na dostępność fosforu w diecie. Jedna cząsteczka kwasu fitynowego może związać 5,1 atomów wapnia, czyli doprowadzając do kompletnej hydrolizy 1% fitynianu w diecie uwolnione zostanie dodatkowe 0,36% wapnia. Ponadto kreda pastewna jest najbardziej rozpowszechnionym źródłem Ca w żywieniu zwierząt, jednak ze względu na wysoką pojemność buforową zwiększa pH przewodu pokarmowego. Wzrost pH wpływa korzystnie na formowanie kompleksów pomiędzy cząsteczką kwasu fitynowego, Ca oraz białkiem. Fityniany mogą łączyć się zarówno z białkami pożywienia jak i enzymów trawiennych. Zmiana struktury połączonego z fityną białka wpływa negatywnie na jego rozpuszczalność oraz strawność. Wykazana również została możliwość powstawania potrójnych kompleksów białka, kwasu fitynowego i węglowodanów. Wiadomo też, że wzrost wartości pH treści pokarmowej sprzyja tworzeniu trudno rozpuszczalnych kompleksów pomiędzy Ca, a nieorganicznymi źródłami fosforu. Z powyższych względów redukcja poziomu Ca w diecie powinna zmniejszać możliwość zajścia interakcji pomiędzy Ca, a cząsteczką fitynianu, białka lub fosforanu, zwiększając tym samym ich rozpuszczalność w jelicie cienkim. Tamim i in. (2004) wykazał, że jeżeli zawartość Ca w diecie kurcząt rzeźnych zostanie obniżona do 0,2%, to strawność fosforu fitynowego, przy braku suplementacji diety fitazą, może wzrosnąć nawet do prawie 80%.
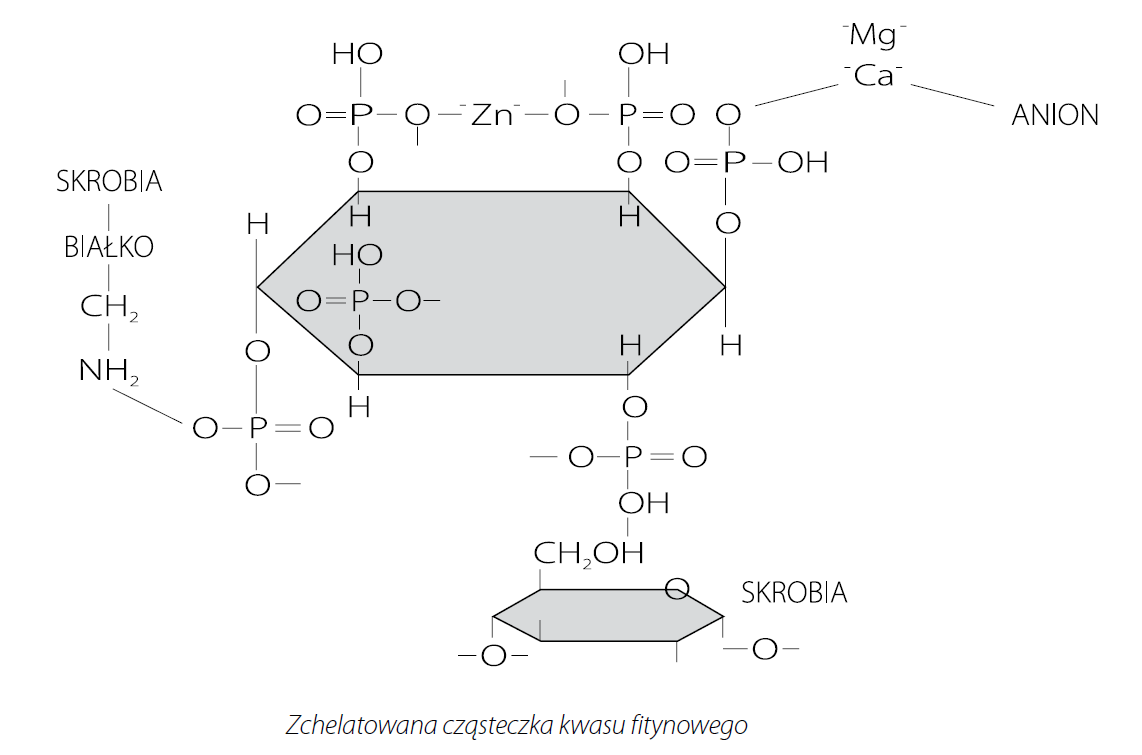
W żywieniu zwierząt, w celu zredukowania negatywnego działania kwasu fitynowego, związek ten powinien ulec degradacji (hydrolizie). Usunięcie grupy fosforanowej z pierścienia mio-inozytolu obniża siłę wiązania kationów przez kwas fitynowy, zwiększając tym samym biodostępność wielu składników pokarmowych, w tym przede wszystkim makro i mikroelementów. Wśród zabiegów technologicznych redukujących zawartość fitynianów w surowcach roślinnych można wymienić między innymi moczenie, kiełkowanie czy fermentację. W większości zabiegów technologicznych hydroliza kwasu fitynowego jest wynikiem działania natywnych enzymów degradujących fityniany – fitaz, naturalnie występujących w roślinach. Jednakże w ostatnich latach najbardziej rozpowszechnionym w przemyśle paszowym oraz najbardziej efektywnym sposobem rozkładu fitynianów stało się stosowanie dodatku egzogennej fitazy mikrobiologicznej.
Fitaza (fosfohydrolaza heksafosforanu mio-inozytolu) należy do enzymów, które przeprowadzają stopniową degradację kwasu fitynowego i jego soli do niższych fosforanów mio-inozytolu. Przyjmując za kryterium podziału mechanizm przeprowadzania reakcji, wśród fitaz można wyróżnić: histydynową kwaśną fosfatazę, β-propeller fitazę, cysteinową fosfatazę, purpurową kwaśną fosfatazę. Natomiast ze względu na optymalne pH dla aktywności, fitazy możemy podzielić na kwaśne – wykazujące maksymalną aktywność enzymatyczną przy pH w zakresie 4,5-6, oraz zasadowe - z optymalnym pH wynoszącym około 8. Z kolei opierając klasyfikację na atomie węgla w pierścieniu mio-inozytolu, od którego następuje defosforylacja cząsteczki fitynianu, fitazy można podzielić na 3-fitazy (EC 3.1.3.8), 6-fitazy (EC 3.1.3.26) i 5-fitazy (EC 3.1.3.72). Enzymy te rozpoczynają hydrolizę wiązania w cząsteczce fitynianu, odpowiednio, od pozycji C3, C6/C4 i C5. Mikroorganizmy zazwyczaj wytwarzają 3-fitazy, natomiast 6-fitazy występują głównie w roślinach. Jednakże od tej ogólnej zasady występują wyjątki. Na przykład enzym o aktywności 3-fitazy został oznaczony w nasionach soi, z kolei enzym produkowany przez Escherichia coli sklasyfikowano jako 6-fitazę. Fitaza „idealna” jako dodatek paszowy powinna spełniać szereg kryteriów jakościowych. W tym między innymi powinna charakteryzować się wysokim powinowactwem do cząsteczki kwasu fitynowego, wysoką aktywnością w niskim pH, odpornością na wysoką temperaturę czy rozkład przez inne enzymy np. proteolityczne przewodu pokarmowego, a także niskim kosztem produkcji. W odniesieniu do defosforylacji fitynianu w przewodzie pokarmowym zwierząt, bardzo ważne jest stężenie jonów wodorowych w poszczególnych jego odcinkach, które w górnych partiach wynosi od 2 do 5, natomiast w dolnych, np. w jelicie cienkim 6,0-7,8. W związku z tym optymalne pH oraz zakres pH dla aktywności katalitycznej w znaczący sposób determinuje przydatność danej fosfatazy jako dodatku paszowego. Obecnie wszystkie fitazy stosowane w żywieniu zwierząt jako dodatki paszowe należą do grupy histydynowych kwaśnych fosfataz, której przedstawiciele wykazują najwięcej cech „idealnej” fitazy. Histydynowe kwaśne fosfatazy wytwarzane są zarówno przez mikroorganizmy, rośliny i zwierzęta. Możemy wyróżnić wśród nich zarówno 3-fitazy jak i 6-fitazy.
Pierwszą fitazą wprowadzoną na rynek enzymów paszowych była 3-fitaza wytwarzana przez Aspergillus niger. Następnym komercyjnym preparatem była 6-fitaza pochodząca od Peniophora lycii. Z kolei ostatnie 10 lat zaowocowało wprowadzaniem do obrotu licznych preparatów zawierających bakteryjną 6-fitazę pochodzącą od Echerichia coli. Jednym z ostatnio skomercjalizowanych produktów została także bakteryjna 6-fitaza, jednakże pochodząca od Citrobacter braakii. Obydwie bakteryjne fitazy wykazują podobny profil pH, z optimum przy około 3,5-4,5, z kolei dla fitaz pochodzenia grzybowego optymalne pH wynosi 5,5 i 4-5, odpowiednio dla 3-fitazy pochodzącej od Aspergillus niger i Peniophora lycii. Poza różnicami w zakresie optymalnego pH, wymienione wyżej preparaty enzymatyczne różnią się także odpornością względem endogennej proteazy czy powinowactwem do substratu. Stwierdzono, że fitazy pochodzenia bakteryjnego charakteryzuje większa odporność na trawienie proteolityczne niż fitazy pochodzenia grzybowego oraz bardzo specyficzne powinowactwo do kwasu fitynowego i jego niższego estru - pięciofosforanu mio-inozytolu (InsP5).
Fitaza jest enzymem zdolnym do przeprowadzania stopniowej hydrolizy fitynianów. W pierwszym etapie reakcji rozerwaniu ulegają wiązania estrowe pomiędzy atomem węgla 3 (3-fitaza) lub 6 (6-fitaza) w pierścieniu mio-inozytolu, a związaną z nim grupą fosforanową. Dalsze wiązania ulegają hydrolizie w określonej dla danej podklasy fitazy kolejności. Kompletna defosforylacja cząsteczki fitynianu może nastąpić tylko w obecności wysokiego stężenia enzymu podczas przedłużonej inkubacji. Jednakże biorąc pod uwagę fakt, iż wraz ze spadkiem ufosforylowania cząsteczki fitynianu, znaczącemu obniżeniu ulega jej zdolność do wiązania dwuwartościowych kationów oraz wzrasta jej rozpuszczalność, co dodatkowo ułatwia działanie endogennej jelitowej fitazy, wydaje się, że ważniejszym aspektem działania egzogennej fitazy jest jak największa redukcja puli InsP6, InsP5, InsP4 i InsP3 (sześcio- i niższych fosforanów mio-inozytolu) trafiająca do dwunastnicy. W przypadku działania 3-fitazy następuje szybka, sekwencyjna redukcja InsP6 do InsP1, z kolei 6-fitaza w pierwszej kolejności hydrolizuje wiązania przy atomie węgla 6 i 1. W konsekwencji zastosowanie fitazy pochodzenia grzybowego i bakteryjnego w tej samej dawce wyrażonej w jednostkach aktywności, prowadzi do uwolnienia tej samej ilości fosforu, jednakże z tą różnicą, iż bakteryjna fitaza dokona częściowej hydrolizy większej ilości cząstek fitynianów, znosząc w większym stopniu ich antyżywieniowy wpływ. Wyżej opisane różnice we właściwościach oraz sposobie działania poszczególnych fitaz mogą stanowić jeden z głównych czynników wpływających na ich skuteczność w warunkach in vivo.

Pomimo iż w układzie pokarmowym zwierząt nieprzeżuwających wykryto aktywność fitazy w śluzówce jelit, stopień degradacji fitynianów przez te zwierzęta jest niewielki. Dlatego, jak już wcześniej wspomniano, zwiększenie stopnia hydrolizy fitynianów oraz dostępności fosforu fitnowego, może zostać osiągnięte między innymi przez stosowanie dodatku egzogennej fitazy mikrobiologicznej. Ponadto wielokrotnie wykazano, iż dodatek egzogennej fitazy do mieszanek paszowych dla drobiu i trzody chlewnej poprawia wyniki odchowu, strawność i wchłanianie makro i mikroelementów oraz aminokwasów, a także wartość pozornej energii metabolicznej (AMEn) diety. Jednak pomimo faktu, że fitaza jest jednym z najbardziej zbadanych egzogennych enzymów stosowanych w żywieniu zwierząt nieprzeżuwających, nadal nie są w pełni poznane mechanizmy oraz efekty jej oddziaływania na organizm zwierząt. Ostatnie doniesienia naukowe wykazują, iż wpływ dodatku fitazy na organizm zwierząt jest złożony, niemniej jednak potwierdzają zaangażowanie w tym procesie mio-inozytolu. Zastosowanie tzw. super dawki fitazy (wielokrotnie większej od standardowo zalecanej) może prowadzić do kompletnej hydrolizy fitynianów, doprowadzającej do uwolnienia cząsteczki fosforu i mio-inozytolu, związku szeroko rozpowszechnionego w komórkach zarówno roślin jak i zwierząt, biorącego udział w wielu istotnych szlakach metabolicznych. Rola, jaką spełnia mio-inozytol nie jest do końca poznana, jednakże wydaje się być niezbędny dla normalnego funkcjonowania komórek. Stwierdzono również, że w żywieniu ssaków mio-inozytol wykazuje podobne właściwości i funkcje metaboliczne do insuliny, co może świadczyć o jego wpływie na regulację transportu glukozy, glukoneogenezę oraz syntezę białek. Z przeprowadzonych badań wynika, iż dodatek mio-inozytolu wykazuje pozytywny wpływ na wyniki odchowu kurcząt rzeźnych. Dodatkowo mio-inozytol stanowi źródło węgla dla niektórych bakterii (np. Bacillus subtilis i Lactobacillus casei). Ponadto w innych badaniach zostało także wykazane, że zastosowanie dodatku fitazy podnosi poziom mio-inozyto lu we krwi, co może świadczyć o zwiększonej koncentracji mio-inozytolu również w świetle przewodu pokarmowego, a tym samym zwiększoną jego dostępność nie tylko dla organizmu gospodarza, ale także dla mikrobiomu jelitowego. Czyni to mio-inozytol potencjalnym czynnikiem modyfikującym populacje endogennej mikroflory przewodu pokarmowego, która tworzy złożony mikro-ekosystem, pozostający w ścisłych interakcjach nie tylko pomiędzy sobą, ale także z organizmem gospodarza. Zastosowanie dodatku egzogennej fitazy niweluje antyżywieniowy wpływ fitynianów, poprawiając dostępność wielu składników odżywczych dla gospodarza i jednocześnie ograniczając pulę substratów dla fermentacji bakteryjnej. Dodatkowo większość producentów enzymów paszowych tworzy dla swoich produktów odpowiednie matryce opracowane na podstawie wieloletnich doświadczeń żywieniowych. W przypadku fitazy, w zależności od zastosowanej dawki, szacowany wzrost dostępności dla fosforu fitynowego (ekwiwalent fitazy) zwiera się w przedziale od 1,2 do 3 g/kg paszy, co w praktyce oznacza, iż o tyle mniej fosforu przyswajanego możemy dodać do mieszanki z innych źródeł np. fosforanów. Jednakże stosowanie dodatku egzogennej fitazy wraz z uwzględnieniem potencjalnego wzrostu biodostępności fosforu i wapnia prowadzi do znaczącego wzrostu udziału kredy w stosunku do fosforanów w mieszance paszowej. Ważnym aspektem stosowania egzogennej fitazy mikrobiologicznej w żywieniu zwierząt nieprzeżuwających jest również efekt środowiskowy. Wzrost przyswajalności fosforu z surowców roślinnych zmniejsza udział fosforanów paszowych, co przyczynia się do mniejszej emisji tego pierwiastka do środowiska naturalnego.
Literatura dostępna u autora.
dr inż. Anna Rogalska
PIAST PASZE Sp. z o. o.